弱酸(酢酸水溶液)の電離度と pH の求め方(高校化学)
酢酸は水に溶けても完全に電離しないので、(塩酸や水酸化ナトリウム水溶液のように)水溶液の濃度がそのまま水素イオン濃度になるわけではない。酢酸の一部は電離して水素イオンを放出するが、残りの大部分は分子のままである。
酢酸の場合、約 1% が電離して水素イオンを放出するが、残りの 99% は電離しない(数値はだいたいの目安)。この電離する割合を電離度という。
電離度と電離定数
酢酸は水に溶けると一部が次のように電離する。
CH3COOH → CH3COO- + H+
化学平衡の法則から下の式が成り立つ。
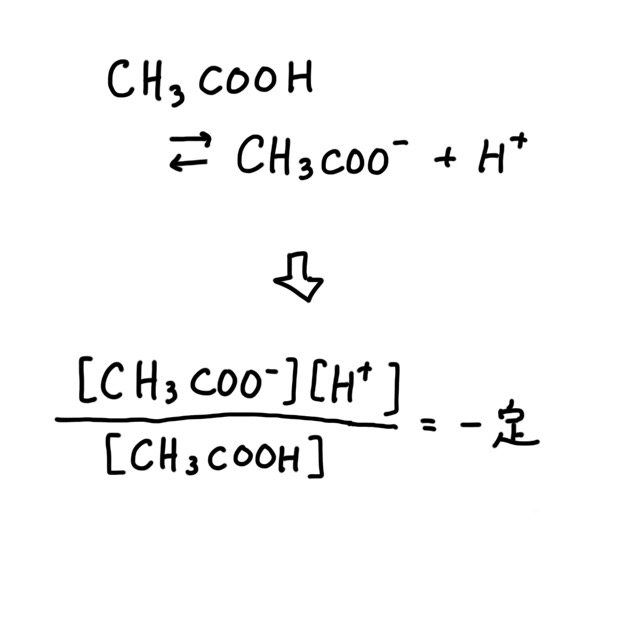
この定数を電離定数といい、高校の教科書などでは Ka と表す。電離定数 Ka は濃度によらない。モル濃度などはモル濃度と質量パーセント濃度と質量モル濃度の違いと変換公式を参照。
電離定数
酢酸水溶液の濃度を $C$、電離度を $\alpha$ として、$K$ を用いて電離式を変形する。
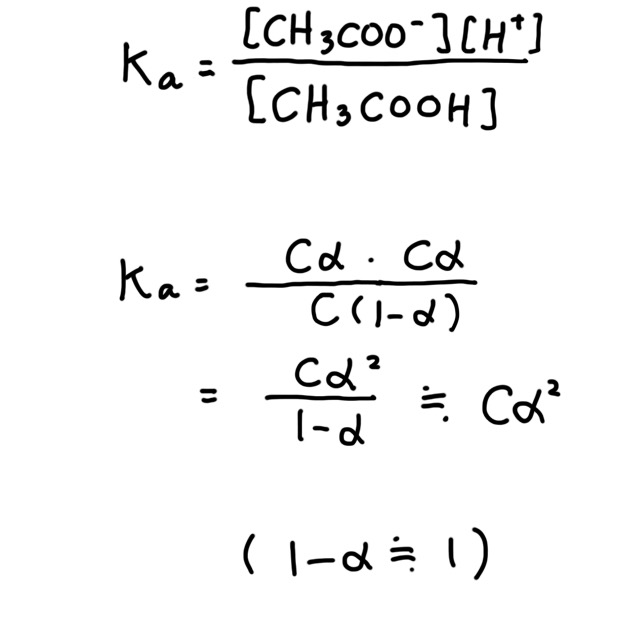
$\alpha$ はとても小さいので $1 - \alpha = 1$ とみなす。
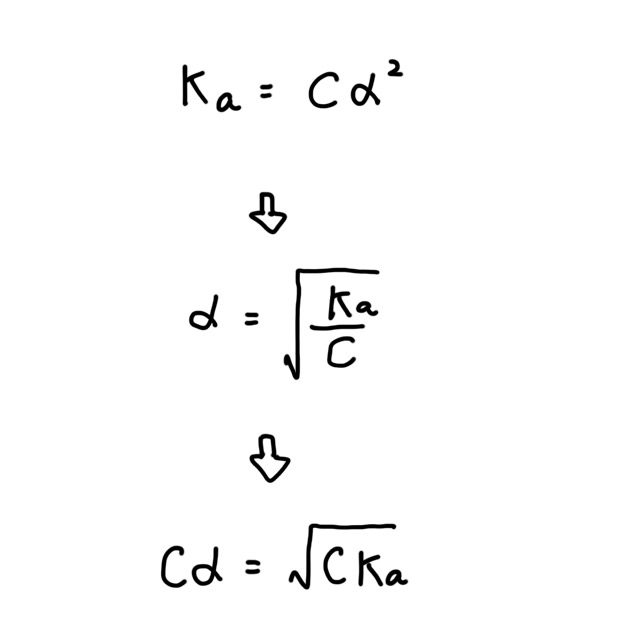
pHの求め方
pH は水素イオン濃度の log をとってマイナスにした値である。pH は水素イオン濃度 $Cα$ を使って次のように求める。
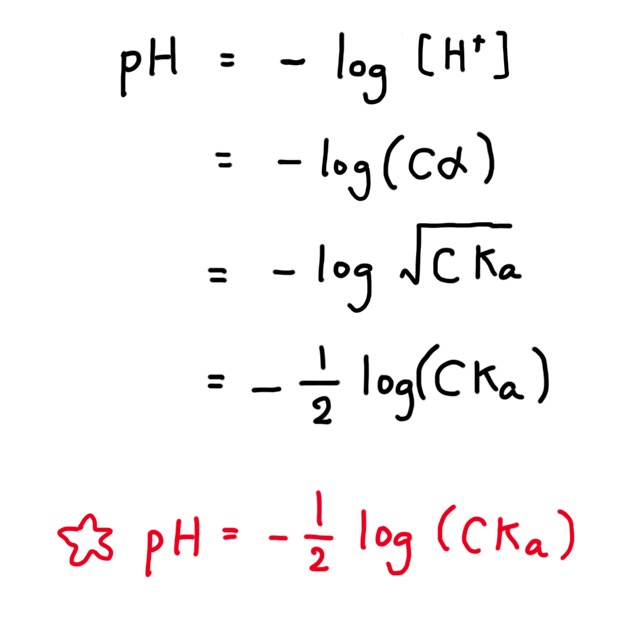
酸と塩基

-
 酸・塩基の定義と強酸・強塩基のpHの求め方
酸・塩基の定義と強酸・強塩基のpHの求め方0
4684
-
 弱酸(酢酸水溶液)の電離度と pH の求め方(高校化学)
弱酸(酢酸水溶液)の電離度と pH の求め方(高校化学)0
97868
-
 緩衝液(酢酸と酢酸ナトリウムの混合液)
緩衝液(酢酸と酢酸ナトリウムの混合液)0
1013




