中2理科 原子と分子、単体と化合物(水、二酸化炭素、食塩などの化学式)
物質は細かくできる。例えば角砂糖は砕いて粉末状にできる。岩も風雨にさらされて細かくなり、やがて石になる。石もまた転がったり踏まれたりして細かくなり、やがて砂になる。
このようにあらゆる物質は細かくできる。しかし「それ以上細かくできない物質」がある。ここまできたら分けることができないという物質。これを分子という。
分子はその物質の性質を示す最小単位である。例えば食塩の最小単位である分子は塩化ナトリウムという分子、塩酸の最小単位である分子は塩化水素という分子である。
塩化ナトリウムという分子は基本的にパカッと分けることはできない。分けてしまうと、もはやそれは食塩ではないまったく別の物質になってしまう。

分子はその物質の性質を示す最小単位。基本的にそれ以上分けられず、もし分けてしまうともはやその物質は別の物質になってしまう。
「基本的に」という言葉が示すように、実は分子も無理やり分けられる。塩化ナトリウム分子を無理やり分けると塩素とナトリウムが出てくる。するともはや食塩ではない、非常に危険な物質(塩素もナトリウムも危険)が生まれる。
しかしこの塩素とナトリウムはどんな方法をもってしてもそれ以上分けることはできない。塩素は塩素でしかなく、ナトリウムなナトリウムでしかない。この「真にそれ以上分けられない物質」を原子という。
原子の性質
- それ以上分けられない。
- 化学反応によって生まれたり、消えたり、他の原子になったりしない。
- その物質が気体、液体、固体になっても、それを構成する原子が別の原子になることはない。
- 質量(重さ)が決まっている。化学反応によって質量は変化しない。
- 種類によって大きさが異なる。
- 一つ一つにアルファベットの記号が割り当てられている(H、O、Cなど)。
化学の教科書の表紙の裏についている表を周期表という。周期表にはこれまで発見されたすべての原子がのっている。
周期表は、原子を軽いものから重いものまで順番に並べている。下にいけばいくほど重く、右にいけばいくほど重い。したがって一番左上にある水素が最も軽い原子である。
中2理科で習う原子リスト
- H … 水素
- O … 酸素 (ゼロではない。アルファベットのオー)
- C … 炭素
- N … 窒素
- Na … ナトリウム
- Cl … 塩素
- Fe … 鉄
- Ag … 銀
- Cu … 銅
- Mg … マグネシウム
- Ca … カルシウム
特に水素、酸素、炭素、窒素の四つは非常に重要。
分子
前述のとおり、物質の最小単位を分子という。分子は基本的にそれ以上分けることはできない。それ以上分けるとその物質はまったく別の物質に変わってしまう。
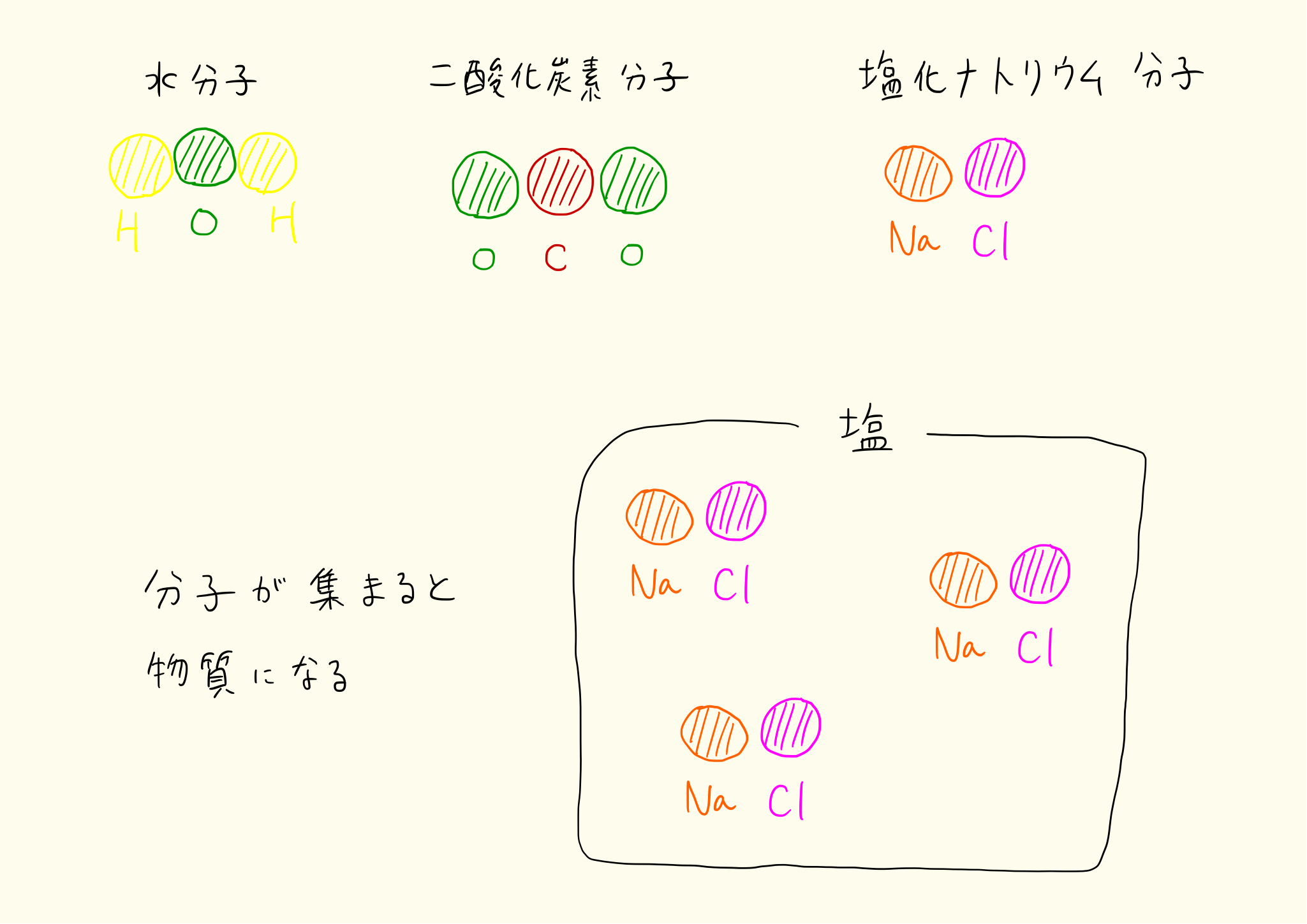
分子の代表的な例
- 水 = 酸素 + 水素
- 二酸化炭素 = 炭素 + 酸素
- 塩化ナトリウム = 塩素 + ナトリウム
塩化ナトリウム分子は、1個の塩素原子と1個のナトリウム原子がくっついた分子。一方、二酸化炭素は1個の炭素原子と2個の酸素原子がくっついた分子。
上の式だと二酸化炭素に含まれる酸素の個数がわからない。分子を構成する原子の個数をわかるようにしたものを化学式という。
化学式の例
- 二酸化炭素 … CO2
- 塩化ナトリウム … NaCl
- アンモニア … NH3
同じ原子が1個のときは数字を書かず、同じ原子が2個以上あるときは数字を右下に書く。例えばアンモニア分子に含まれる水素原子(H)の数は3個で、窒素原子の数は1個。
単体と化合物
物質を構成する原子が一種類のものを単体、二種類以上のものを化合物という。例えば鉄はどこまで細かくしても鉄でしかなく、最小単位は鉄原子である。したがって鉄は単体となる。
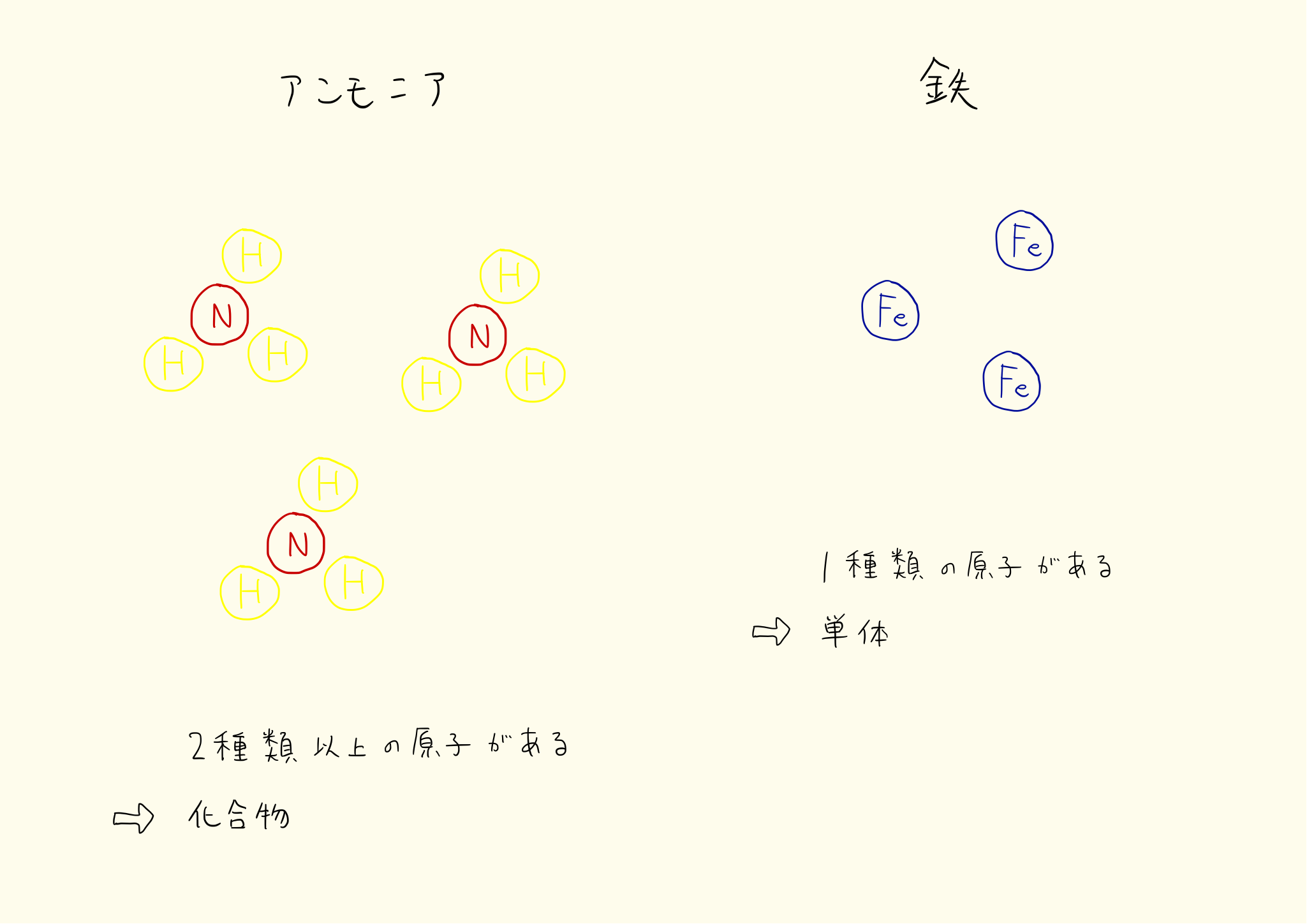
その物質が単体か化合物かの判断は、分子が一種類の原子でできているか、二種類の原子でできているかの違いでわかる。
単体の例
- H2
- O2
- N2
- C
- Fe
- Ag
化合物の例
- H2O
- CO2
- NH3
- NaCl
中2理科

-
 炭酸水素ナトリウムと酸化銀の熱分解と水の電気分解(中2理科)
炭酸水素ナトリウムと酸化銀の熱分解と水の電気分解(中2理科)0
14077
-

-

-
 質量保存の法則のわかりやすい説明|中2理科
質量保存の法則のわかりやすい説明|中2理科0
27830
-
 中2理科まとめ|中間・期末試験対策の要点解説
中2理科まとめ|中間・期末試験対策の要点解説0
9374
-
 中学生物 血液の成分(赤血球、白血球、血小板)と組織液
中学生物 血液の成分(赤血球、白血球、血小板)と組織液0
15807
-

-
 脊椎動物の分類(呼吸、体温、変温動物と恒温動物)|中学理科・生物
脊椎動物の分類(呼吸、体温、変温動物と恒温動物)|中学理科・生物0
11589
-
 中学理科(高校物理)の電力、電力量、ジュール熱
中学理科(高校物理)の電力、電力量、ジュール熱0
1104
-

-
 凝結と飽和水蒸気量(中学理科)
凝結と飽和水蒸気量(中学理科)0
4046
-
 電力と電力量の公式と説明(中学理科)
電力と電力量の公式と説明(中学理科)0
18995
-
 天気・風の記号と雲量(中学理科)
天気・風の記号と雲量(中学理科)0
43694
-
 真空放電と電子線(中2理科)
真空放電と電子線(中2理科)0
2509
-
 感覚神経と運動神経と反射(中学理科)
感覚神経と運動神経と反射(中学理科)0
8645
-
 生物の進化~相同器官と痕跡器官(中学理科)
生物の進化~相同器官と痕跡器官(中学理科)0
6595
-
 食塩、砂糖、小麦粉を加熱する実験|中学化学
食塩、砂糖、小麦粉を加熱する実験|中学化学0
10905
-
 小腸と柔突起の図と解説
小腸と柔突起の図と解説0
1130
-
 中生代の区分(三畳紀、ジュラ紀、白亜紀)
中生代の区分(三畳紀、ジュラ紀、白亜紀)0
7481
-
 電源、電球、電流計、電圧計などの記号|中学理科
電源、電球、電流計、電圧計などの記号|中学理科0
11573
-
 植物細胞と動物細胞の構造と基本的な働き(中2理科2学期)
植物細胞と動物細胞の構造と基本的な働き(中2理科2学期)0
1733
-

-
 単体と化合物の違いと例
単体と化合物の違いと例0
108
-
 中学理科で覚えるべき化学反応式のまとめ
中学理科で覚えるべき化学反応式のまとめ0
2667
-
 溶解度:飽和水溶液と再結晶
溶解度:飽和水溶液と再結晶0
184
-
 無機物と有機物の基本(中学化学)
無機物と有機物の基本(中学化学)0
187
-
 固体の体積を求める方法
固体の体積を求める方法0
1011




