質量保存の法則のわかりやすい説明|中2理科
質量保存の法則は、反応前後の重さが変わらないという法則です。例えば、1g の砂糖を 100g の水に溶かして砂糖水を作るとき、砂糖水の重さはいくらでしょうか?
1 + 100 = 101
答えは 101g。
砂糖水の重さは、水の重さと砂糖の重さを足した値です。砂糖を水に溶かす前と後で、全体の質量は変わっていません。
炭酸水素ナトリウムと塩酸の反応と質量保存の法則
炭酸水素ナトリウムに塩酸を加えると二酸化炭素が発生します。
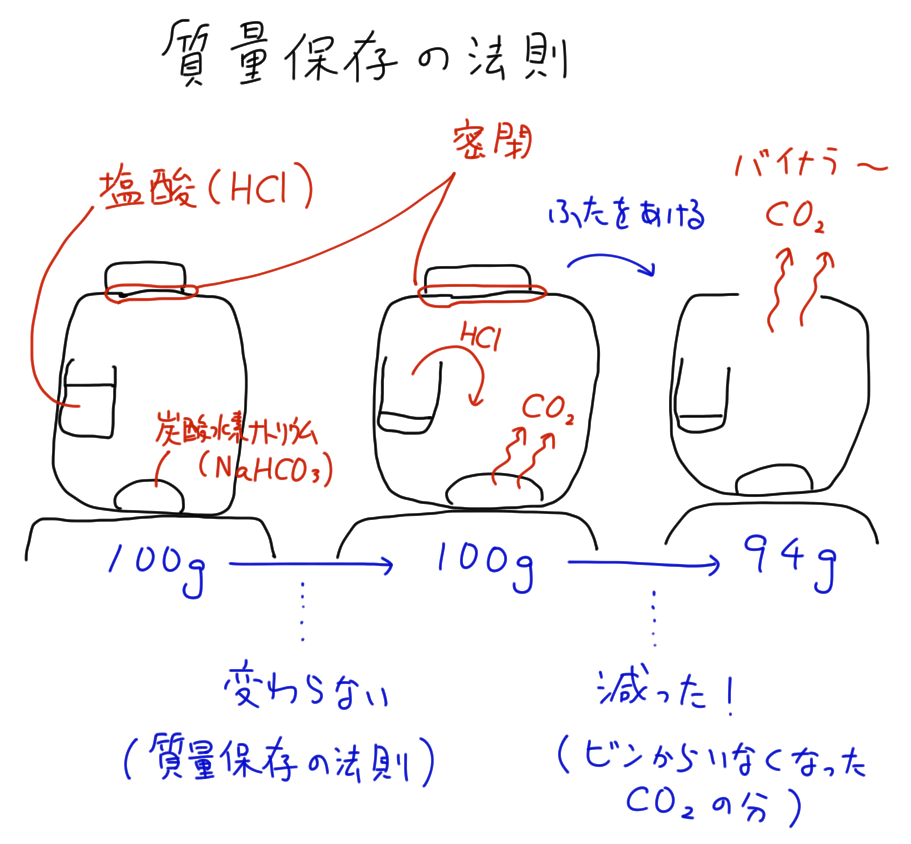
上の実験は質量保存の法則を確かめる有名な実験です。
まずビンの中に塩酸と炭酸水素ナトリウムを別々に入れます(左図)。例えば 100g だったとします。
次にビンを傾けて塩酸を炭酸水素ナトリウムに垂らす。化学反応が起きて二酸化炭素が発生する(中央の図)。しかし重さはあいかわらず 100g です。
塩酸と炭酸水素ナトリウムが別々にあるときも、化学反応が起きて二酸化炭素が発生したときも、全体の重さは変わらない。質量保存の法則が成り立っているからです。
しかしビンのふたを開けて二酸化炭素を逃がすと、全体の重さが減ってしまう(右図)。
炭酸水素ナトリウムと塩素の化学反応によって発生した二酸化炭素の重さは
100 - 94 = 6
6g です。
中2理科

-
 炭酸水素ナトリウムと酸化銀の熱分解と水の電気分解(中2理科)
炭酸水素ナトリウムと酸化銀の熱分解と水の電気分解(中2理科)0
14077
-

-

-
 質量保存の法則のわかりやすい説明|中2理科
質量保存の法則のわかりやすい説明|中2理科0
27830
-
 中2理科まとめ|中間・期末試験対策の要点解説
中2理科まとめ|中間・期末試験対策の要点解説0
9374
-
 中学生物 血液の成分(赤血球、白血球、血小板)と組織液
中学生物 血液の成分(赤血球、白血球、血小板)と組織液0
15807
-

-
 脊椎動物の分類(呼吸、体温、変温動物と恒温動物)|中学理科・生物
脊椎動物の分類(呼吸、体温、変温動物と恒温動物)|中学理科・生物0
11589
-
 中学理科(高校物理)の電力、電力量、ジュール熱
中学理科(高校物理)の電力、電力量、ジュール熱0
1104
-

-
 凝結と飽和水蒸気量(中学理科)
凝結と飽和水蒸気量(中学理科)0
4046
-
 電力と電力量の公式と説明(中学理科)
電力と電力量の公式と説明(中学理科)0
18995
-
 天気・風の記号と雲量(中学理科)
天気・風の記号と雲量(中学理科)0
43694
-
 真空放電と電子線(中2理科)
真空放電と電子線(中2理科)0
2509
-
 感覚神経と運動神経と反射(中学理科)
感覚神経と運動神経と反射(中学理科)0
8645
-
 生物の進化~相同器官と痕跡器官(中学理科)
生物の進化~相同器官と痕跡器官(中学理科)0
6595
-
 食塩、砂糖、小麦粉を加熱する実験|中学化学
食塩、砂糖、小麦粉を加熱する実験|中学化学0
10905
-
 小腸と柔突起の図と解説
小腸と柔突起の図と解説0
1130
-
 中生代の区分(三畳紀、ジュラ紀、白亜紀)
中生代の区分(三畳紀、ジュラ紀、白亜紀)0
7481
-
 電源、電球、電流計、電圧計などの記号|中学理科
電源、電球、電流計、電圧計などの記号|中学理科0
11573
-
 植物細胞と動物細胞の構造と基本的な働き(中2理科2学期)
植物細胞と動物細胞の構造と基本的な働き(中2理科2学期)0
1733
-

-
 単体と化合物の違いと例
単体と化合物の違いと例0
108
-
 中学理科で覚えるべき化学反応式のまとめ
中学理科で覚えるべき化学反応式のまとめ0
2667
-
 溶解度:飽和水溶液と再結晶
溶解度:飽和水溶液と再結晶0
184
-
 無機物と有機物の基本(中学化学)
無機物と有機物の基本(中学化学)0
187
-
 固体の体積を求める方法
固体の体積を求める方法0
1011




