水の三態変化(融解・凝固・蒸発・凝縮・昇華)と状態図の三重点と臨界点
物質は固体、液体、気体という三つの状態をとる。これらをまとめて三態という。態は状態の「態」。三態変化とは、固体から液体、液体から気体と物質の状態が変わること。
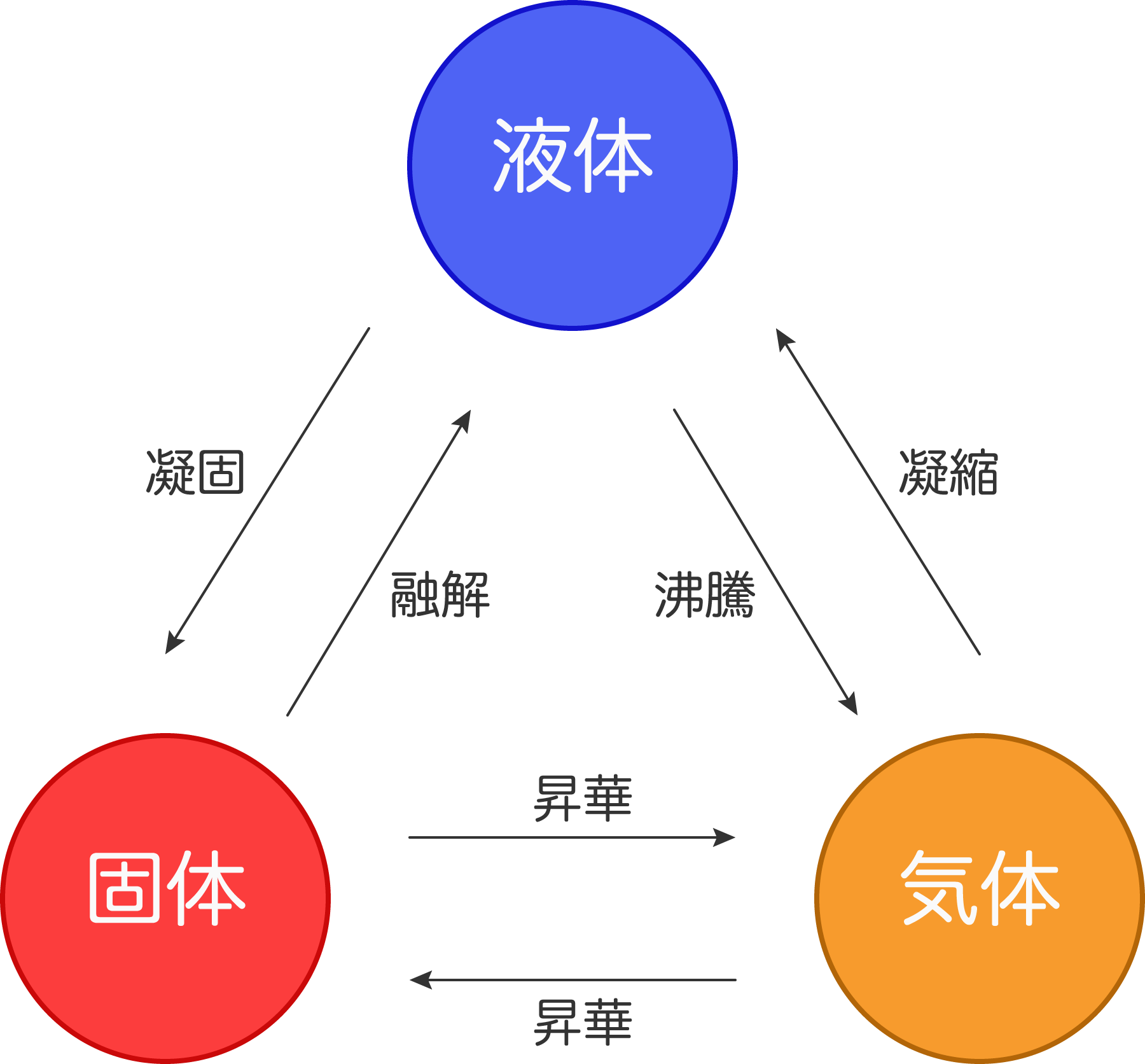
| 変化 | 言葉 |
|---|---|
| 固体 → 液体 | 融解 |
| 液体 → 固体 | 凝固 |
| 液体 → 気体 | 蒸発 |
| 気体 → 液体 | 凝縮 |
| 固体 → 気体 | 昇華 |
水の三態

氷が融けると水になり、水の温度がさらに上がると水蒸気になる。やかんの水を熱していくと白い湯気が出る。湯気がどんどん出てきたら、その水は 100°C に近づくが、湯気そのものは水蒸気でなく液体の水である。水蒸気は気体であり色はない。
- 湯気は液体
- 水蒸気は気体
沸騰する直前のやかんをよく見ると、湯気が口から少し離れてモクモクとたっている。口の中から白い湯気が出ているわけではないとわかる。無色の水蒸気が口から出て、その水蒸気が空気に接し、急に冷えて液体の湯気になる。
状態図
一般的な物質は温度を上げていくと固体、液体、気体の順に変化するが、実際は物質をかこむ空間の圧力に依存する。
水もぴったり 0°C で氷から水にとけるとは限らない。圧力を上げていくと 0°C でも液体のままである。
ポイント:物質の三態は温度と圧力の二つで決まる。
「この温度、この圧力のとき、物質は固体なのか、液体なのか、気体なのか?」という疑問に答える図が、横軸を温度、縦軸を圧力とした状態図。
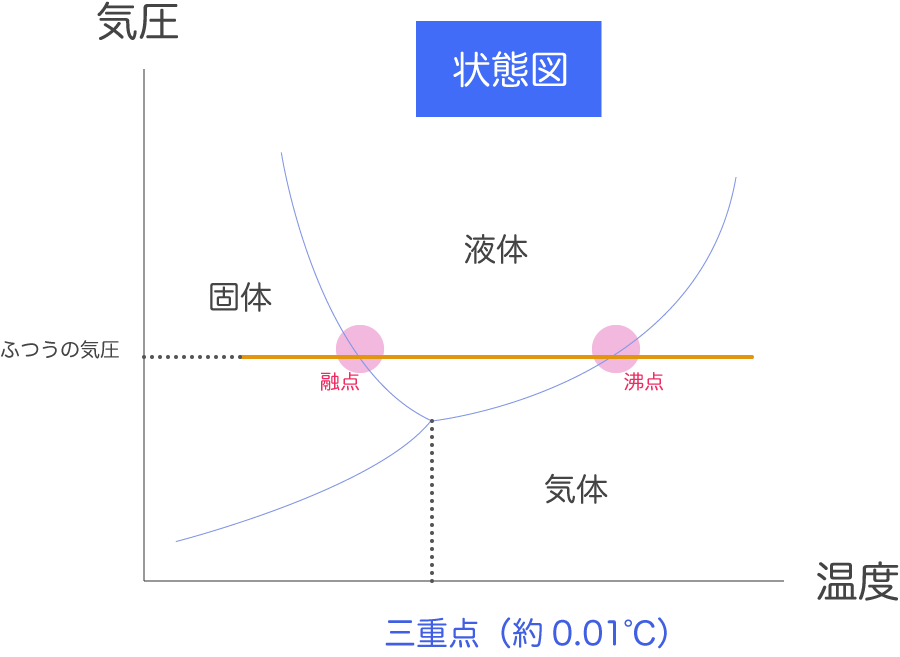
状態図は物質の三態を表す。
固体と液体と気体の境界を確認しよう。状態図の境界にある点は、その温度と圧力において物質は同時に二つの状態を持つ。水も 0°C では水と氷の二つの状態を持つ。
三重点
上の状態変化の図において、固体、液体、気体を分ける線が一ヶ所に集まっている点がある。これを三重点という。
三重点において水は固体、液体、気体のすべてが共存する。水以外の物質も一般的に三重点を持つが、その温度と圧力はばらばらである。
水の三重点
温度 … 0.01 °C(273.16 K)
圧力 … 611.654771007894 Pa
三重点の温度はおよそ 0.01 °C(正確には 273.16 K) で、圧力は 600 Pa 程度である。実は、温度の単位は、水の三重点をもとに定められている。
- 絶対零度を 0 K、水の三重点を 273.16 K とする
- 1 K を水の三重点の逆数とする
- 1 ° の量を 1 K と同じ値にする
- セルシウス温度をケルビン温度から 273.16 だけ引いた値とする
水の三重点は自然のあらゆる温度の基準とみなされている。
臨界点
状態図を見ると、液体と気体の境界線が臨界点で止まっている。
臨界点(温度) … 647.096 K
臨界点(圧力) … 22.064 MPa
臨界点の温度はおよそ 374 °、圧力はおよそ 22,000,000 Pa (地球の気圧の 200 倍以上)である。臨界点に近い状態では、水蒸気の圧力が極度に大きくなり、水蒸気と液体の水の密度がほとんど同じになる。いわば「限りなく液体に近い水蒸気」が液体の水と共存している状態である。
臨界点を超えて温度と圧力を上げると、水は液体でも気体でもない「なにか」になる。この状態を超臨界状態といい、超臨界状態にある水を超臨界水という。超臨界状態とプラズマは異なる。超臨界水は金をも溶かす強力な酸化力をもつ。
物質の状態

-
 分子結晶、共有結晶、金属結晶、イオン結晶の例と比較
分子結晶、共有結晶、金属結晶、イオン結晶の例と比較0
104711
-
 高校化学 混合物の分離法
高校化学 混合物の分離法0
2428
-
 原子番号と元素記号と元素名リスト
原子番号と元素記号と元素名リスト0
9235
-

-
 電解質溶液と非電解質溶液の沸点上昇度と凝固点降下度
電解質溶液と非電解質溶液の沸点上昇度と凝固点降下度0
12484
-

-





