原子の電子配置(第4周期まで)と電子軌道のエネルギー準位
| K | L | L | M | M | M | N | N | |
| s | s | p | s | p | d | s | p | |
| H | 1 | |||||||
| He | 2 | |||||||
| Li | 2 | 1 | ||||||
| Be | 2 | 2 | ||||||
| B | 2 | 2 | 1 | |||||
| C | 2 | 2 | 2 | |||||
| N | 2 | 2 | 3 | |||||
| O | 2 | 2 | 4 | |||||
| F | 2 | 2 | 5 | |||||
| Ne | 2 | 2 | 6 | |||||
| Na | 2 | 2 | 6 | 1 | ||||
| Mg | 2 | 2 | 6 | 2 | ||||
| Al | 2 | 2 | 6 | 2 | 1 | |||
| Si | 2 | 2 | 6 | 2 | 2 | |||
| P | 2 | 2 | 6 | 2 | 3 | |||
| S | 2 | 2 | 6 | 2 | 4 | |||
| Cl | 2 | 2 | 6 | 2 | 5 | |||
| Ar | 2 | 2 | 6 | 2 | 6 | |||
| K | 2 | 2 | 6 | 2 | 6 | 1 | ||
| Ca | 2 | 2 | 6 | 2 | 6 | 2 | ||
| Sc | 2 | 2 | 6 | 2 | 6 | 1 | 2 | |
| Ti | 2 | 2 | 6 | 2 | 6 | 2 | 2 | |
| V | 2 | 2 | 6 | 2 | 6 | 3 | 2 | |
| Cr | 2 | 2 | 6 | 2 | 6 | 5 | 1 | |
| Mn | 2 | 2 | 6 | 2 | 6 | 5 | 2 | |
| Fe | 2 | 2 | 6 | 2 | 6 | 6 | 2 | |
| Co | 2 | 2 | 6 | 2 | 6 | 7 | 2 | |
| Ni | 2 | 2 | 6 | 2 | 6 | 8 | 2 | |
| Cu | 2 | 2 | 6 | 2 | 6 | 10 | 1 | |
| Zn | 2 | 2 | 6 | 2 | 6 | 10 | 2 | |
| Ga | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 1 |
| Ge | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 2 |
| As | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 3 |
| Se | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 4 |
| Br | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 5 |
| Kr | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 |
希ガスでは、最外殻の電子軌道にすべての電子が入っている。また、VからCr、NiからCuにかけて、それまでの規則性が崩れていることがわかる。
第4周期の電子配置
Arまで、つまり第3周期までは、K殻s軌道、L殻s軌道、L殻d軌道…と順番に電子が配置されるが、Scから電子配置が変則的になる。第4周期だけとりだすと次のようになる。
| K | 2 | 2 | 6 | 2 | 6 | 1 | ||
| Ca | 2 | 2 | 6 | 2 | 6 | 2 | ||
| Sc | 2 | 2 | 6 | 2 | 6 | 1 | 2 | |
| Ti | 2 | 2 | 6 | 2 | 6 | 2 | 2 | |
| V | 2 | 2 | 6 | 2 | 6 | 3 | 2 | |
| Cr | 2 | 2 | 6 | 2 | 6 | 5 | 1 | |
| Mn | 2 | 2 | 6 | 2 | 6 | 5 | 2 | |
| Fe | 2 | 2 | 6 | 2 | 6 | 6 | 2 | |
| Co | 2 | 2 | 6 | 2 | 6 | 7 | 2 | |
| Ni | 2 | 2 | 6 | 2 | 6 | 8 | 2 | |
| Cu | 2 | 2 | 6 | 2 | 6 | 10 | 1 | |
| Zn | 2 | 2 | 6 | 2 | 6 | 10 | 2 | |
| Ga | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 1 |
| Ge | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 2 |
| As | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 3 |
| Se | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 4 |
| Br | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 5 |
| Kr | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 |
アルカリ金属のKとアルカリ土類金属のCaは、電子がM殻d軌道ではなく、N殻s軌道に入る。そしてN殻s軌道が埋まると、その後はM殻d軌道に1、2、3と入っていくが、CrとCuで順番が再び逆転する。高校化学でもCrとCuは「特殊な元素」として扱われるが、その特殊性はこの変則的な電子配置が影響している。
第4周期の電子配置の特殊性
- KとCaはM殻d軌道ではなく、N殻に電子が入る
- Sc、Ti、Vまでは電子がM殻d軌道に順番に入る
- CrはN殻s軌道の電子が1個だけM殻d軌道に移る
- Mn、Fe、Co、Niは順番に入る
- CuはN殻s軌道の電子が1個だけM殻d軌道に移る
電子配置が変則的になるScからCuまでを遷移元素という。
1sから5fまでのエネルギー準位
エネルギー準位が高い順
5f
5d
4f
5p
4d
5s
4p
3d
4s
3p
3s
2p
2s
1s
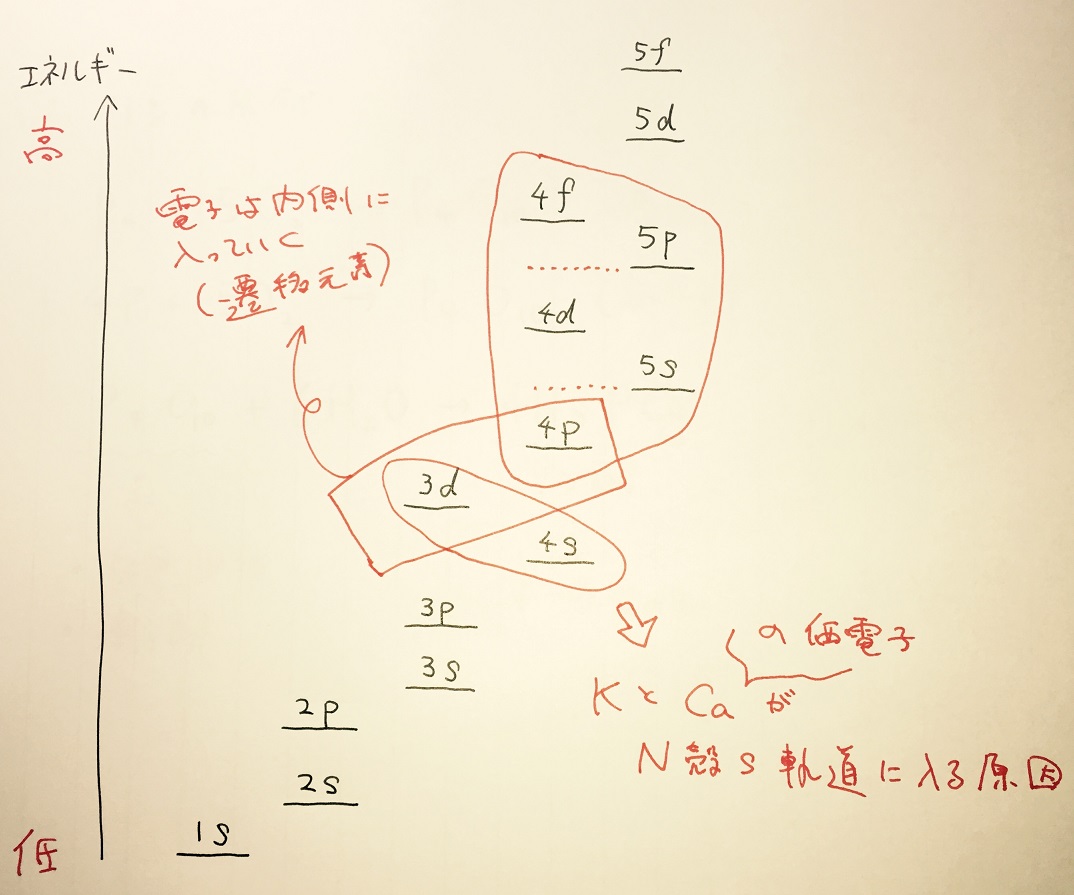
エネルギー準位に応じて電子は入る。3dよりも4sのほうがエネルギー順位が低いことから、KとCaでは価電子が内側の3d(M殻d軌道)でなく、外側の4s(N殻s軌道)に入る。Sc以降は、4pでなく3dに電子が入る。
理論化学

-
 化学の基本法則 質量保存・定比例・倍数比例の法則など要点まとめ
化学の基本法則 質量保存・定比例・倍数比例の法則など要点まとめ0
17904
-
 モル濃度と質量パーセント濃度と質量モル濃度の違いと変換公式
モル濃度と質量パーセント濃度と質量モル濃度の違いと変換公式0
35705
-
 電子殻と電子軌道(s軌道とp軌道)|高校化学
電子殻と電子軌道(s軌道とp軌道)|高校化学0
101785
-
 高校化学で覚えるべき原子量一覧:原子量の意味と定義を確認しよう
高校化学で覚えるべき原子量一覧:原子量の意味と定義を確認しよう0
30249
-
 高校化学に出てくる潮解性の物質
高校化学に出てくる潮解性の物質0
37082
-
 理論化学のページ(高校化学)
理論化学のページ(高校化学)0
1100
-
 密度=質量/体積=モル質量/モル体積(化学基礎)
密度=質量/体積=モル質量/モル体積(化学基礎)0
72897
-
 原子の電子配置(第4周期まで)と電子軌道のエネルギー準位
原子の電子配置(第4周期まで)と電子軌道のエネルギー準位0
28559
-
 強磁性のある元素(高校化学)
強磁性のある元素(高校化学)0
836
-
 ドルトンの分圧の法則
ドルトンの分圧の法則0
208




