高校化学・脂肪族化合物の総まとめ:炭化水素の分類、エチレンやアセチレン、アルコール、カルボン酸の性質と反応
高校化学で習う有機化学の脂肪族化合物を(ほとんど)すべてまとめました。随時更新しています。
炭化水素の分類
炭化水素はメタンやベンゼンなどの炭素と水素の化合物で、単結合のみの炭化水素を飽和炭化水素、二重結合や三重結合が含まれる炭化水素を不飽和炭化水素といいう。
| 分類 | 結合 |
|---|---|
| 飽和炭化水素 | 単結合のみ |
| 不飽和炭化水素 | 二重結合以上あり |
飽和炭化水素をアルカン、二重結合を一つ持つ不飽和炭化水素をアルケン、三重結合を一つ持つ不飽和炭化水素をアルキンと呼ぶ。
| 分類 | 結合 |
|---|---|
| アルカン | 飽和 |
| アルケン | 二重 |
| アルキン | 三重 |
炭化水素はベンゼンのような環状構造を持っているかどうかでも分類できる。環状構造を持つ炭化水素を環式炭化水素、環状構造を持たない炭化水素を鎖式炭化水素というが、環式炭化水素のうちベンゼン環を持つものは特に芳香族炭化水素と呼ばれる。二重結合を二つ持つ炭化水素はアルケンと言わない。
| 化合物 | 性質 |
|---|---|
| メタン | 鎖式、飽和(アルカン) |
| エチレン | 鎖式、不飽和(アルケン) |
| アセチレン | 鎖式、不飽和(アルキン) |
| シクロヘキサン | 環式、飽和(シクロアルカン) |
| シクロヘキセン | 環式、不飽和(シクロアルケン) |
| ベンゼン | 環式、不飽和(芳香族炭化水素) |
例えばエタノールは、酸素が含むので炭化水素ではない。
アルカン、アルケン、アルキンの水素数
| 名称 | 化学式 |
|---|---|
| アルカン | CnH2n+2 |
| アルケン | CnH2n |
| アルキン | CnH2n-2 |
| シクロアルカン | CnH2n |
| シクロアルケン | CnH2n-2 |
| ベンゼン | C6H6 |
| ナフタレン | C10H8 |
- 二重結合が1つ増えるごとに水素の数は2つ減る
- 三重結合が1つ増えるごとに水素の数は4つ減る
- 環状構造が1つ増えるごとに水素の数は2つ減る
- ベンゼン環を持つものは別に覚える
アルカン
アルカンは CnH2n+2 で表される有機化合物で、例えばメタン、エタン、プロパンがあります。
二重結合はなく、単結合しかありません。単結合は、それを軸にして炭素がくるくる回転できるような感じになっており、化合物全体がいろいろな形をとることができます。
対して二重結合があるものは、二重結合にある両方の炭素原子とそれについている水素原子が固定されています。自由な形をとることができません。
アルカンの名前はメタン、エタンなどンで終わるものが多い。
| n | 分子式 | 名称 |
|---|---|---|
| 1 | CH4 | メタン |
| 2 | C2H6 | エタン |
| 3 | C3H8 | プロパン |
| 4 | C4H10 | ブタン |
| 5 | C5H12 | ペンタン |
| 6 | C6H14 | ヘキサン |
| 7 | C7H16 | ヘプタン |
| 8 | C8H18 | オクタン |
| 9 | C9H20 | ノナン |
シクロアルカン
アルカンでも炭素が環状に結合した物質をシクロアルカンといいます。シクロアルカンはアルカンと同じく、他の有機化合物(アルケン)と比べて、化学的に安定しています。
アルケンとアルキン
二重結合を持つ炭化水素化合物をアルケン、三重結合を持つものをアルキンといいます。
アルケン … CnH2n
アルキン … CnH2n-2
アルケンもアルキンも酸化されやすく、水素などと付加反応を起こしやすい性質を持ちます。例えば過マンガン酸カリウム水溶液にエチレンやアセチレンは酸化されます。この反応では酸化マンガンの黒色沈殿が出てきます。
ポイント アルケンとアルキンは過マンガン酸カリウム水溶液で酸化され、酸化マンガンの黒色沈殿が発生する。
アルケンの水素原子の数は炭素原子の数のちょうど2倍でわかりやすい。ただしこれはアルケンの二重結合が1つしかない場合です。二重結合が1つ増えると水素原子の数は2個ずつ減ります。
エチレンやプロペンはアルケンです。エチレンの構造を見てみましょう。
エチレンを構成するすべての原子は同一平面上にあります。これはアルカンと大きく異なる性質です。アルカンは単結合しかなく、それを軸にして構造が回転するため、立体的な構造をとります。
エチレンと水素を結合させるとエタンになる。アルケンは一般的に水素と反応してアルカンになります。この反応を付加反応といいます。
アルキンは三重結合を持ち、反応性に富みます。高校化学ではアセチレンが代表的な例です。
エチレン
2個の炭素に4個の水素が結合した物質をエチレンという。エチレンは1個の二重結合をもつ。最も炭素数の小さいアルケンであり、不飽和炭化水素である。

エチレンの性質
分子式はC2H4、構造式はCH2=CH2。無色で、かすかに臭い。可燃性で、工業的に可燃性・引火性ガスに指定される。
構造は単純だが、さまざまな物質と反応する。
エチレンの反応
エチレンの二重結合に水素を付加するとエタンになる。これは不飽和炭化水素が飽和炭化水素になる反応である。
エチレンに水を付加する(水和)とエタノールになる。エタノールはアルコールの一種で、第一級アルコール。
エチレンを付加重合させるとポリエチレンになる。
エチレンの製法
高校化学では、エタノールと濃硫酸を混ぜてつくる。濃硫酸はエタノールを脱水させるために使い、温度は160℃~170℃にする。
温度に注意する。温度が低いとエチレンではなくジエチルエーテルがつくられてしまう。
エタノール→エチレン(160℃~170℃)
エタノール→ジエチルエーテル(130℃)
どちらも濃硫酸による脱水反応。
アセチレンの性質
アセチレンは C2H2 の分子。三重結合があり、アルキンである。2つの炭素と2つの酸素が一直線上にならぶ。三重結合があるため、反応性が大きく、燃焼熱も大きい。爆発の危険性がある。
アセチレンの危険性を検証した動画
一番目の動画ではわずかな量で爆発していることがわかる。
アセチレンと酸素を混ぜて完全燃焼させると、非常に大きな熱を取りだすことができる。この熱を酸素アセチレン炎という。また、アセチレンは燃やしたときにススが多量に発生する。
アセチレンの反応
アセチレンは塩化ビニルや酢酸ビニルなどの材料になる。
アセチレン+塩化水素→塩化ビニル
アセチレン+酢酸→ 酢酸ビニル
塩化ビニルを重合するとポリ塩化ビニル、酢酸ビニルを重合するとポリ酢酸ビニルになり、ポリ酢酸ビニルはビニロンになる。
アセチレン+酢酸
↓
酢酸ビニル
↓
ポリ酢酸ビニル
↓ (けん化)
ポリビニルアルコール
↓ (アセタール化)
ビニロン
アセチレンの製法
高校化学では二つの製法を習う。
カーバイド+水
CaC2 + 2H2O → Ca(OH)2 + C2H2
炭化カルシウム(CaC2)をカーバイドという。これに水を加えると、水酸化カルシウムとアセチレンが生じる。この反応は試験でよく問われる。
炭化水素の熱分解
メタンなどを1,000℃以上に加熱すると、分解してアセチレンを生じる。
ビニルアルコールとアセトアルデヒド
アセチレンに水を付加するとアセトアルデヒドができる。アセチレンに酢酸を加えると酢酸ビニルができるが、これは三重結合がほどかれて二重結合になり、水素と酢酸が炭素原子につく反応である。
アセチレンと水の反応も、酢酸ビニルと同様、HとOHが炭素原子について三重結合が二重結合になる。その結果ビニルアルコールができるが、ビニルアルコールは非常に不安定であるため、すぐに安定したアセトアルデヒドになる。
アセチレン+水
→ビニルアルコール
→アセトアルデヒド
ビニルアルコールはビニロンの原料になるが、この不安定な性質からビニロンを作るときはポリ酢酸ビニルを経由する。
アセチレン検出
アセチレンの水素原子は銀原子に置換されやすく、この反応はアセチレンの検出に使われる。
アンモニア性硝酸銀水溶液にアセチレンを加えると、アセチレンの水素と銀が置換し、銀アセチリド(Ag2C2)という物質ができる。
C2H2 + 2AgNO3 + 2NH3
→ Ag2C2 + 2NH4NO3
銀アセチリド(Ag2C2)は非常に危険な物質である。
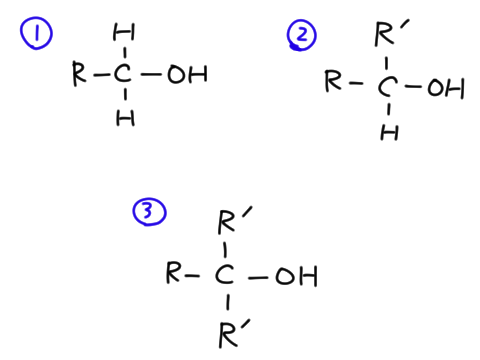
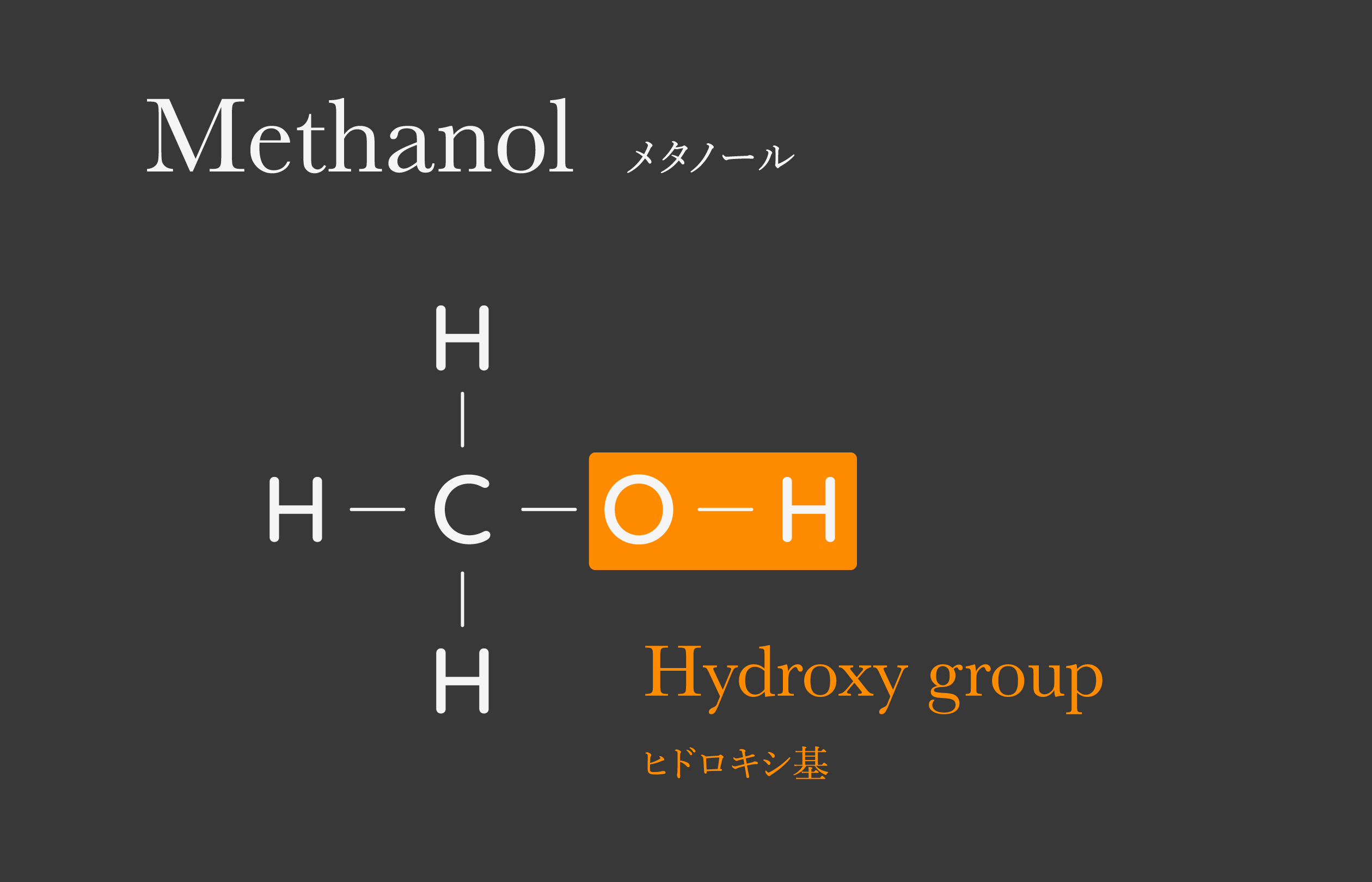
アルコール
ヒドロキシ基のある有機化合物をアルコールという。アルコールはヒドロキシ基のつきかたによって3種類ある。
- 第一級アルコール
- 第二級アルコール
- 第三級アルコール
それぞれは下図の各番号に対応する。
高級アルコールと低級アルコール
炭素数の多いアルコールは高級アルコール、炭素数の少ないアルコールは低級アルコールといわれる。メタノールやエタノールは低級アルコールといえる。
1価、2価、3価アルコール
アルコールは、ヒドロキシ基が1つであれば1価、2つであれば2価、3つであれば3価と分類される。
メタノールは1価、エチレングリコール(PET(ポリエチレンテレフタレート)の原料)は 2 価、グリセリンは 3 価である。
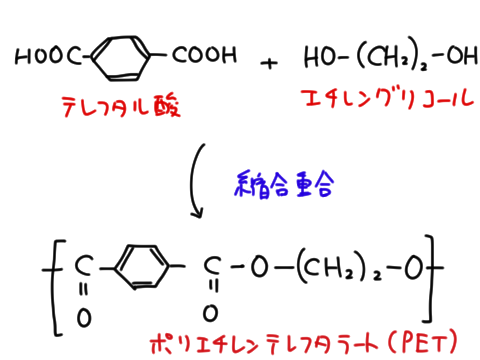
エチレングリコールとテレフタル酸が単量体となり、それぞれの二重結合が解かれて鎖状につながったものをポリエチレンテレフタレートという。
またグリセリンは油脂やセッケンで出てくる。
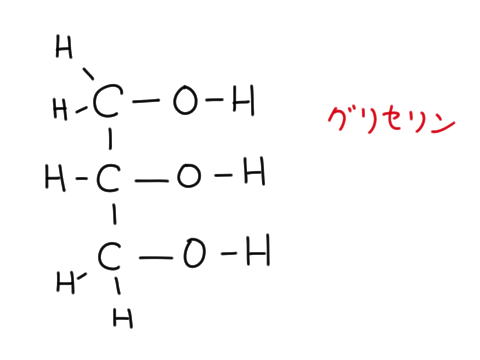
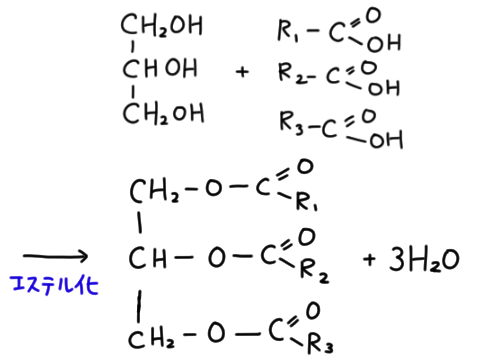
後述するようにアルコールとカルボン酸は反応してエステルになるが、グリセリンと3つのカルボン酸がエステル化した分子を油脂という。
アルコールの例
第一級アルコール
メタノール、エタノール
第二級アルコール
2-プロパノール
第三級アルコール
2-メチル-2-プロパノール
アルコールの酸化
第一級アルコールは酸化されるとアルデヒドになる。アルデヒドはさらに酸化されるとカルボン酸になる。
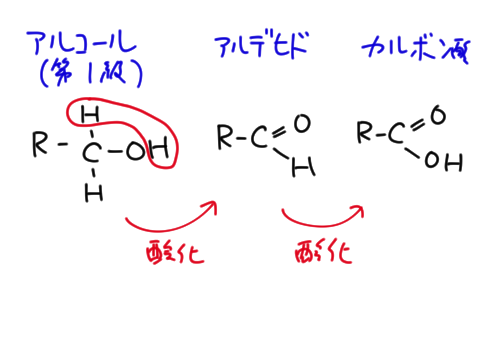
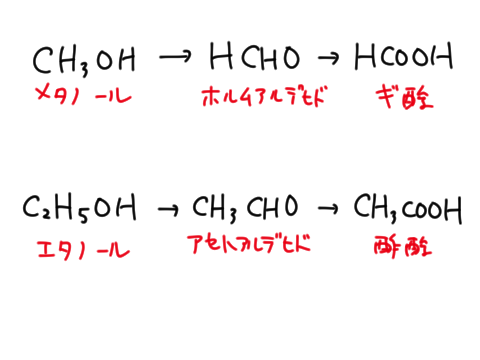
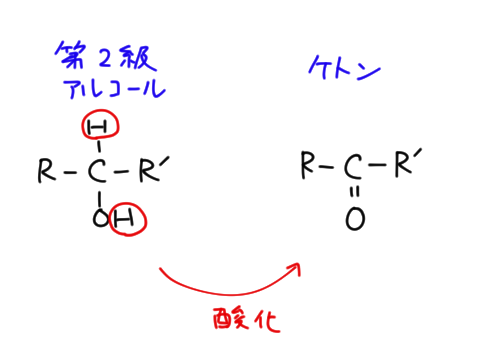
第二級アルコールは酸化されるとケトンになる。
第三級アルコールは酸化されない。
アルコールとナトリウム
アルコールにナトリウムを入れると水素が発生する。
2CH3OH + 2Na → 2CH3ONa + H2↑
有機化合物の検出において、その対象がアルコールかどうか(ヒドロキシ基をもっているかどうかは)、ナトリウムを入れて水素が発生するかどうかでわかる。
ケトン
ケトンはCO(Cと0は二重結合)という構造を持つ有機物です。第二級アルコールを酸化するとケトンになります。第一級アルコールを酸化するとアルデヒドになりましたね。ケトンは第二級アルコールです。
ケトンは、ジエチルエーテルといったエーテルと同じように、有機溶媒として使われます。
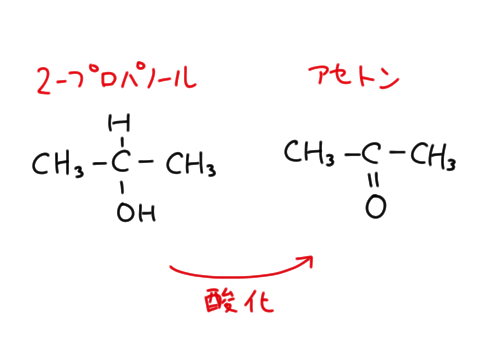
アセトン
ケトンの代表例はアセトンです。ケトンといったらアセトンを指すくらい、アセトンはよく使われます。アセトンは芳香性があり、引火性があります。
2-プロパノール → アセトン(酸化)
アセトンはヨードホルム反応を起こし、黄色沈殿ヨードホルムが生じます。
復習(ヨードホルム反応)
反応を確かめたい物質(例えばアセトン)とヨウ素ヨウ化カリウム水溶液の混合液に水酸化ナトリウム水溶液を少しずつ加えると、液体からヨウ素の茶色が消えていき、黄色沈殿が生じます。これをヨードホルム反応といいます。
ヨードホルム反応はCH3COやCH3CHOHの構造を持つ化合物に起きます。
カルボン酸
カルボン酸とは、COOH基を持つ有機物のことです。COOHをカルボキシル基といいます。酢酸はカルボン酸の1つです。
性質
カルボン酸は水に溶けます。酸という文字がついているように酸性です。酸の強さは、炭酸より強く、塩酸より弱い。
カルボン酸はアルコールと反応してエステルになります。
例
| 名称 | 分子式 |
|---|---|
| ギ酸 | HCOOH |
| シュウ酸 | (COOH)2 |
| 酢酸 | CH3COOH |
| プロピオン酸 | C2H5COOH |
| 酪酸 | C3H7COOH |
| ラウリン酸 | C11H23COOH |
| トリデシル酸 | C12H25COOH |
| パルミチン酸 | C15H31COOH |
| ステアリン酸 | C17H35COOH |
ギ酸
ギ酸は分子式が最も小さいカルボン酸で、カルボキシル基とアルデヒド基の両方を持つため、酸でありながら還元性を持ちます。
酢酸
酢酸は2分子が結合して水分子がとれると無水酢酸という物質になります。無水酢酸は中性です。
大学受験では無水酢酸の構造式はよく問われるので書けるようにしましょう。
フマル酸とマレイン酸
フマル酸はトランス型、マレイン酸はシス型です。マレイン酸は、加熱していくと分子内で脱水反応が起きて無水マレイン酸になります。これも無水酢酸と同じように構造式は試験でよく出てくる。
エステル
エステルは COO という構造を持つ、カルボン酸とアルコールが結合した物質。エステルは水にほとんど溶けず、ジエチルエーテルなどの有機溶媒には溶ける。
カルボン酸とアルコールの脱水反応では濃硫酸を加える。吸湿性があり乾燥剤としてよく使われる濃硫酸は、カルボン酸の OH とアルコールの H を奪うことで脱水反応を促進します。濃硫酸そのものは変化しないので、濃硫酸は一種の触媒である。
エステルに水酸化ナトリウムを加えて加熱すると、もとのカルボン酸とアルコールに分解する。例えば酢酸エチルに水酸化ナトリウムを加えて加熱すると、酢酸ナトリウムとエタノールが出てきます(カルボン酸はカルボン酸ナトリウムという塩として出てくる)。
有機化学

-
 アルコールの性質と酸化(第一級、第二級、第三級アルコール)
アルコールの性質と酸化(第一級、第二級、第三級アルコール)0
76041
-

-
 -OH ヒドロキシ基の性質
-OH ヒドロキシ基の性質0
322
-
 油脂の構造、性質、分類
油脂の構造、性質、分類0
620
-

-

-
 ケトンの構造と性質
ケトンの構造と性質0
301
-
 カルボン酸の構造と性質
カルボン酸の構造と性質0
404
-
 アセチレンの性質、反応、製法
アセチレンの性質、反応、製法0
8984
-
 エチレンの性質、反応、製法(濃硫酸による脱水反応)
エチレンの性質、反応、製法(濃硫酸による脱水反応)0
8752
-
 エステル(COO)の構造と性質
エステル(COO)の構造と性質0
441
-
 飽和脂肪酸と不飽和脂肪酸の例と略記(生理学)
飽和脂肪酸と不飽和脂肪酸の例と略記(生理学)0
3398
-
 炭化水素の分類と飽和と不飽和、鎖式と環式による水素の数の違い
炭化水素の分類と飽和と不飽和、鎖式と環式による水素の数の違い0
21225
-
 乳酸と光学異性体(L乳酸とD乳酸)の構造
乳酸と光学異性体(L乳酸とD乳酸)の構造0
24415
-
 高校化学で習うカルボン酸一覧
高校化学で習うカルボン酸一覧0
5192
-
 ケトンとアセトンの性質とアセトンの4つの製造法
ケトンとアセトンの性質とアセトンの4つの製造法0
28154
-
 アルデヒドの性質と化合物(ホルムアルデヒドとアセトアルデヒド)
アルデヒドの性質と化合物(ホルムアルデヒドとアセトアルデヒド)0
33430
-
 グリセリンとセッケンとけん化
グリセリンとセッケンとけん化0
4656
-
 グリセリンと油脂と油脂の種類
グリセリンと油脂と油脂の種類0
6466
-
 酢酸と無水酢酸(分子内脱水反応)
酢酸と無水酢酸(分子内脱水反応)0
12890
-
 高校有機化学(有機化合物、芳香族、高分子)のまとめページ
高校有機化学(有機化合物、芳香族、高分子)のまとめページ0
23640
-
 図でわかるカルボン酸の種類と例(ギ酸、オレイン酸、マレイン酸…)
図でわかるカルボン酸の種類と例(ギ酸、オレイン酸、マレイン酸…)0
18665
-
 有機化合物の官能基一覧
有機化合物の官能基一覧0
97602
-





